Методология флоуметрии, Выпуск 4, 2000 г. стр.121-138.
Влияние дезипрамина на нейрогенные ответы изолированной хвостовой артерии крысы
О. С. Тарасова1, А. В. Зотов1, И. М. Родионов1, В. О. Голубинская2, А. С. Боровик3
1Кафедра физиологии человека и животных
Биологического факультета МГУ им. М. В. Ломоносова,
2Лаборатория гравитационной физиологии Учебно-исследовательского
Центра космической биомедицины,
3Лаборатория кибернетики Института хирургии им. А. В. Вишневского
РАМН
В регуляции тонуса кровеносных сосудов и уровня артериального давления важная роль принадлежит симпатической нервной системе. Важным звеном нейрогенной регуляции сосудистого тонуса является преобразование управляющих сигналов, приходящих по симпатическим нервам, в сокращение гладкой мышцы сосуда. Ранее мы разработали методику, позволяющую изучать нейрогенное сокращение одиночных изолированных сосудов [2]. Эта методика позволяет исследовать различные характеристики сокращения сосудов в ответ на заданное нейрогенное воздействие (величину ответа, длительность фазы сокращения, скорость сокращения, длительность фазы расслабления) и обладает важными особенностями. Во-первых, перфузия сосуда проводится в условиях постоянного давления, которые более адекватно моделируют условия живого организма. Во-вторых, для раздражения нервов, расположенных в стенке исследуемого сосуда, можно использовать любые заданные последовательности импульсов, в том числе и последовательности импульсов, полученные из нейрограмм, зарегистрированных у животных в различных функциональных состояниях.
Кроме исследования фундаментальных механизмов симпатической регуляции сосудистого тонуса, эта методика может быть использована для тестирования действия различных фармакологических препаратов, в том числе и тех, для которых влияние на сосудистый тонус является «побочным», т.е. лежит вне сферы основного клинического применения. В данной работе описаны изменения нейрогенных ответов сосудов при действии дезипрамина, который относится к классу веществ, называемых трициклическими антидепрессантами [3]. Их используют для лечения депрессивных состояний различной этиологии, которые сопряжены с подавлением активности моноаминергических систем головного мозга, в первую очередь, норадренергической [1]. Трициклические антидепрессанты блокируют захват медиаторных моноаминов пресинаптическими нервными окончаниями. Поскольку нейрональный захват является основным механизмом инактивации этих медиаторов, увеличивается время их жизни в синаптической щели и, следовательно, усиливается их постсинаптическое действие.
Однако следует отметить, что адренергические синапсы широко распространены не только в центральной нервной системе, но и на периферии. Поскольку норадреналин является медиатором постганглионарных симпатических нейронов, действие трициклических антидепрессантов может приводить к изменению симпатической регуляции сосудистого тонуса. Следует отметить, что этот вопрос изучался и ранее [9, 13], но с использованием изометрической регистрации сокращения, условия которой далеки от условий сокращения гладкой мышцы сосуда in vivo. Используя преимущества разработанной нами методики, мы решили более детально исследовать, как изменяются характеристики сосудистых ответов на раздражение симпатических нервов после блокады нейронального захвата норадреналина дезипрамином.
Материалы и методы исследования
Эксперименты проводили на самцах крыс линии Вистар весом 190-290 г. В качестве объекта исследования была выбрана хвостовая артерия крысы – крупный сосуд мышечного типа.
Экспериментальная установка для перфузии сосудов в режиме постоянного давления была описана ранее [2]. Сегмент сосуда длиной 5-6 мм находился в термостатируемой камере (37°С), заполненной раствором Кребса–Хенселейта, содержащим (мМ): NaCl – 119, NaHCO3 – 25, KCl – 4,7, KH2PO4 – 1,18, MgSO4 – 1,17, ЭДТА – 0,026, D-глюкоза – 5,5, CaCl2 – 2,5. Раствор аэрировали смесью 95%О2 + 5%СО2, pH 7,35. Во время эксперимента измеряли давление на входе и на выходе перфузируемого сосуда, а также объемную скорость тока перфузата. Давление регистрировали с помощью емкостного датчика ДДА-2, для регистрации потока использовали ультразвуковой флоуметр (Transonic System Inc., T106). Проточный датчик (типа 1N) флоуметра встраивали в перфузионную систему перед входной канюлей. Для раздражения периартериальных нервов с обеих сторон сосуда помещали платиновые электроды.
Давление на входе и на выходе сосуда создавали гидростатически. Поскольку сопротивления входной и выходной канюль были приблизительно равны, трансмуральное давление в сосуде определяли как среднее арифметическое входного и выходного давлений. Разность давлений на входе и на выходе из сосуда в экспериментах составляла 25 мм рт.ст.
Регистрацию и обработку экспериментальных данных проводили с помощью оригинальной программы на компьютере типа IBM PC с использованием 16–разрядного аналого-цифрового преобразователя (L-card, Москва). Частота оцифровки составляла 10 Гц. Одновременно с регистрацией данных в ходе эксперимента программа управляла работой электростимулятора, что позволяло проводить раздражение любой заданной последовательностью импульсов. Раздражение проводили прямоугольными импульсами тока со сменой полярности, амплитудой 200–300 мА и длительностью 0,2 мс. Ответ сосуда на такую стимуляцию полностью блокировался тетродотоксином (5×10-6 М), т.е. сокращение было нейрогенным.
Для раздражения использовали два типа паттернов импульсов:
а) пачки импульсов различной частоты;
б) последовательности импульсов с заданной средней частотой и мгновенной
частотой, изменяющейся по синусоидальному закону.
Частота импульсов в пачке составляла 2, 4 или 8 Гц, интервалы между пачками – 3 мин. Длительность пачки была выбрана равной 10 с, поскольку при дальнейшем увеличении длительности исследуемые параметры сократительного ответа практически не изменялись.
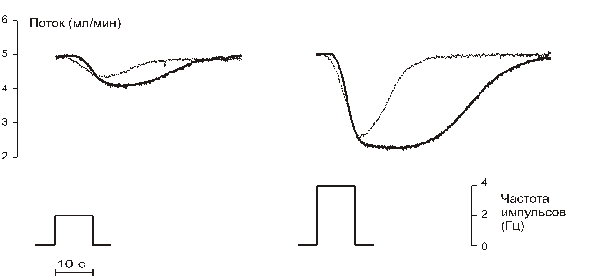
Рисунок 11.1.Изменение потока через сосуд при раздражении симпатических нервов пачками импульсов длительностью 10 с. Частота импульсов в пачке равна 2 Гц (слева) и 4 Гц (справа). Тонкая линия – контроль; толстая – при действии дезипрамина.
Примеры ответов сосуда на раздражение нервов такими пачками импульсов приведены на рис.11.1. Вычисляли следующие параметры сократительного ответа:
максимальное изменение эквивалентной площади просвета сосуда (ΔS)max;
максимальная скорость
уменьшения площади просвета сосуда 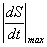 ;
;
время до развития максимальной скорости уменьшения площади просвета;
время достижения минимума площади просвета;
время полурасслабления;
Эквивалентную площадь просвета
сосуда S вычисляли, используя формулу Пуазейля: 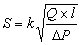 , где Q – объемная скорость тока перфузата, l – длина фрагмента сосуда, ΔP – разность давлений на входе и на выходе из сосуда, k – коэффициент пропорциональности.
, где Q – объемная скорость тока перфузата, l – длина фрагмента сосуда, ΔP – разность давлений на входе и на выходе из сосуда, k – коэффициент пропорциональности.
«Синусоидальная» стимуляция
имитирует ритмы, наблюдающиеся в эфферентных симпатических нервах в состоянии
относительного покоя [12]. Длительность интервала между двумя последовательными
импульсами
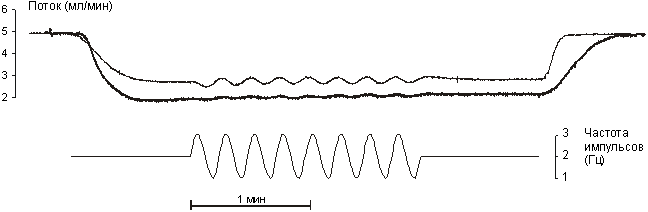
Рисунок 11.2.
Изменение потока через сосуд при «синусоидальном» раздражении симпатических
нервов.
Тонкая линия – контроль;
толстая – при действии дезипрамина.
Средняя частота следования импульсов в синусоиде была равна 2 Гц, что близко к среднему значению частоты фоновой симпатической активности [4, 12]. Амплитуда синусоиды составляла 1 Гц, т.е. частота следования импульсов изменялась по синусоидальному закону от 1 до 3 Гц. Частота модулирующей синусоиды составляла 0,03, 0,07 или 0,15 Гц, длительность стимуляции – 2 мин, а интервалы между воздействиями – 7 мин. Перед «синусоидальной» стимуляцией и сразу после нее проводилась стимуляция с постоянной частотой 2 Гц в течение 1 мин.
В этих экспериментах определяли следующие параметры сократительного ответа сосуда:
среднее уменьшение потока (тонический компонент сократительного ответа сосуда);
задержку сократительной реакции (ее определяли по положению первого максимума функции взаимной корреляции частоты стимуляции и гидравлического сопротивления сосуда);
амплитуду колебаний потока (фазический компонент сократительного ответа сосуда).
Следует отметить, что эти два режима стимуляции дополняют друг друга. «Синусоидальный» режим стимуляции позволяет разделить тонический и фазический компоненты сократительной реакции и определить, как зависят характеристики сокращения от частоты модуляции нейрогенного сигнала. В свою очередь, пачечная стимуляция дает возможность определить временные характеристики не только фазы сокращения, но и фазы расслабления гладких мышц сосуда.
В начале каждого эксперимента проводили перфузию в течение 30 мин при давлении 80 мм рт.ст., что приводило к расслаблению гладкой мышцы сосуда. Затем сосуд активировали трехкратным добавлением норадреналина в концентрации 3×10-6 М. Раздражение нервов проводили на фоне небольшого исходного тонуса, созданного с помощью серотонина (5×10-8 М). В ходе эксперимента сначала измеряли реакции сосуда при синусоидальной стимуляции, а затем – при пачечной. После этого к раствору, протекающему через камеру, добавляли дезипрамин в концентрации 10-6 М и через 20 мин инкубации повторяли воздействия.
Статистическую обработку результатов проводили с использованием непараметрических критериев Вилкоксона и Манна-Уитни. Различия считали статистически значимыми при p<0,05. Данные представлены в виде среднее ± ошибка среднего.
Результаты
Перед началом экспериментов
поток через сосуд в среднем был равен
Характеристики сократительного ответа сосуда на «пачечную» стимуляцию представлены на рис.11.3. Видно, что с увеличением частоты импульсов в пачке уменьшение площади просвета сосуда становится более значительным (рис.11.3. А), возрастает и максимальная скорость сокращения (рис.11.3. Б). Время достижения максимальной скорости сокращения (рис.11.3 В) и длительность фазы сокращения (рис.11.3 Г) монотонно уменьшаются, а время полурасслабления (рис.11.3 Д) – увеличивается.
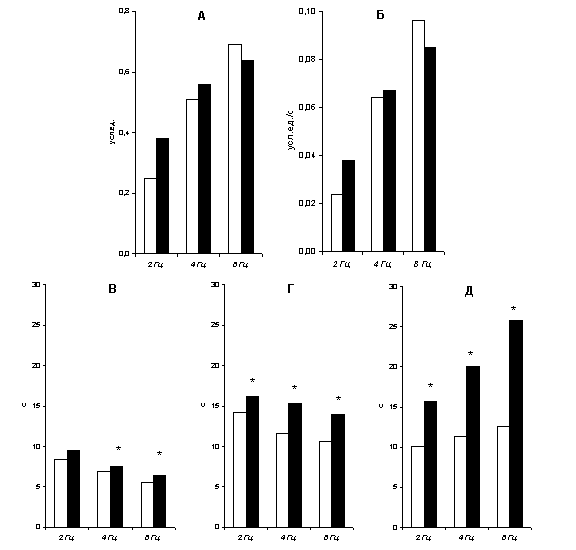
Рисунок 11.3.
Влияние дезипрамина на характеристики сократительного ответа сосуда при
раздражении нервов пачками импульсов длительностью 10 с: А – максимальное
изменение эквивалентной площади просвета сосуда; Б – максимальная скорость
уменьшения площади просвета; В – время до развития максимальной скорости
сужения; Г – время достижения минимума площади просвета; Д – время полурасслабления.
Под столбиками приведены значения частоты следования импульсов в пачке; белые столбики – контроль; черные столбики – после добавления дезипрамина;
* p<0,05 по сравнению с контролем.
Как и следовало ожидать, длительность фазы расслабления после добавления дезипрамина существенно увеличивалась, причем с увеличением частоты импульсов в пачке этот эффект становился более выраженным (рис.11.3. Д). Вместе с тем, блокирование обратного захвата норадреналина не изменило ни величины сужения просвета сосуда, ни максимальной скорости его сокращения (рис.11.3. А, Б). Несколько неожиданным является небольшое, но статистически значимое увеличение длительности фазы сокращения сосуда. После блокады обратного захвата норадреналина время достижения максимальной скорости сокращения было увеличенным при 4 и 8 Гц, время до максимального сужения было больше при всех значениях частоты стимуляции (рис.11.3. В, Г).
При раздражении нервов в синусоидальном режиме на фоне тонического сокращения наблюдаются колебания потока, частота которых соответствует частоте модулирующей синусоиды (рис.11.2.). С увеличением модулирующей частоты происходит уменьшение задержки сократительного ответа сосуда (рис.11.4. А) и амплитуды колебаний потока (рис.11.4. В). Величина тонического компонента сокращения сосуда не зависит от частоты модулирующей синусоиды (рис.11.4. Б), т.к. при всех частотах синусоиды число импульсов за один период было одинаковым (средняя частота стимуляции всегда составляла 2 Гц).
При синусоидальной стимуляции нервов действие дезипрамина приводило к увеличению задержки сократительного ответа сосуда. Тонический компонент сокращения сосуда при этом достоверно не изменялся, а фазический – значительно уменьшался.
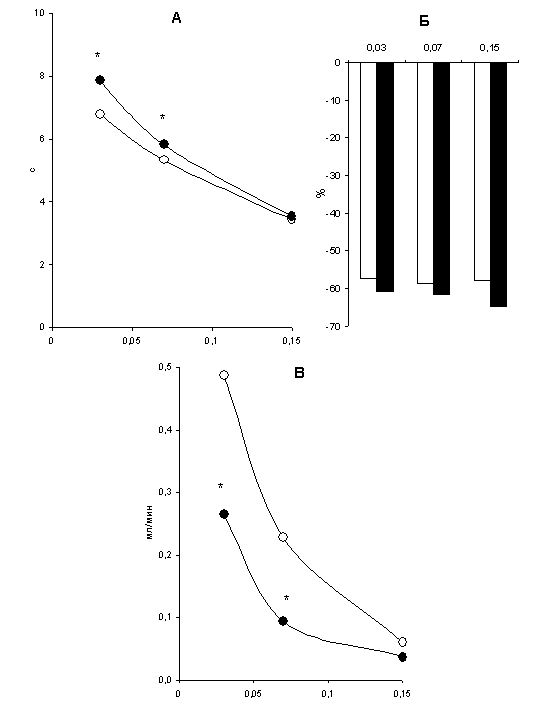
Рисунок 11.4.
Влияние дезипрамина на характеристики сократительного ответа сосуда при
«синусоидальном» раздражении нервов: А – задержка сократительного ответа;
Б – среднее уменьшение потока; В – амплитуда колебаний потока.
По оси абсцисс приведены значения частоты
модулирующей синусоиды; белые кружки и столбики – контроль; черные кружки
и столбики – после добавления дезипрамина;
* p<0,05 по сравнению с контролем.
Обсуждение результатов
Нейрональный захват норадреналина играет важную роль в удалении этого медиатора из синаптической щели. В периферических синапсах обратному захвату подвергается около 80% выделившегося норадреналина и только 20% удаляется путем экстранейронального захвата и диффузии [10]. Электрохимическое измерение концентрации норадреналина показало, что действие блокаторов обратного захвата – кокаина или дезипрамина – значительно увеличивает время полужизни медиатора в синаптической щели, соответственно удлиняется фаза расслабления сосуда [9, 13]. В нашей работе дезипрамин также удлинял фазу расслабления, причем с увеличением интенсивности нейрогенного воздействия этот эффект возрастал. Вероятно, это объясняется тем, что при высокой частоте стимуляции нервов в синаптической области создается более высокая концентрация норадреналина, чем при низкой частоте, поэтому для его удаления (путем вымывания и экстранейронального захвата) требуется большее время.
Интересно, что блокирование обратного захвата увеличивало длительность не только фазы расслабления, но и фазы сокращения сосуда. Это можно объяснить, приняв во внимание, что в постганглионарных симпатических нейронах роль медиаторов играют не только норадреналин, но и другие вещества, в частности, аденозинтрифосфат (АТФ) [8]. Следует отметить, что при действии АТФ сократительный ответ сосуда развивается значительно быстрее, чем при действии норадреналина [5]. Каждый из этих медиаторов может подавлять не только свою собственную секрецию, но и секрецию другого медиатора, действуя через ауторецепторы, расположенные на пресинаптической мембране [8].
«Замедляющее» действие дезипрамина на нейрогенное сокращение ранее наблюдали Todorov et al. [14]. В этой работе регистрировали сокращение семявыносящего протока в ответ на стимуляцию симпатических нервов и одновременно с помощью высокоэффективной жидкостной хроматографии измеряли концентрации медиаторов – норадреналина и АТФ – в оттекающем от препарата растворе. Добавление дезипрамина приводило к замедлению сокращения препарата, причем это было обусловлено уменьшением секреции «быстрого» медиатора АТФ в результате действия норадреналина на пресинаптические a2 - рецепторы. Мы полагаем, что в наших экспериментах причина замедления сокращения при действии дезипрамина была сходной, поскольку в хвостовой артерии крысы АТФ также играет роль «быстрого» симпатического медиатора [5].
Казалось бы, блокирование обратного захвата норадреналина должно приводить к увеличению ответов сосуда на раздражение симпатических нервов. Однако ни амплитуда нейрогенного ответа при «пачечной» стимуляции, ни тонический компонент сокращения при «синусоидальной» стимуляции не возрастали. Это согласуется с данными о том, что хотя дезипрамин и уменьшает клиренс норадреналина, концентрация медиатора в синаптической щели при этом практически не увеличивается [9]. Возможно, что в отсутствии обратного захвата усиливается действие норадреналина на пресинаптические адренорецепторы и поэтому его дальнейшая секреция уменьшается.
Фазический компонент нейрогенного сократительного ответа при действии дезипрамина уменьшался. Вероятно, это является следствием увеличения времени сокращения и замедлением процесса расслабления сосуда. Каждое очередное увеличение частоты стимулирующих импульсов приводит к повышению секреции норадреналина. Поскольку основной механизм удаления медиатора из синаптической щели нарушен, возможно, гладкая мышца сосуда не успевает расслабляться между «вспышками» активности.
По-видимому, увеличение задержки сократительного ответа в ответ на «синусоидальную» стимуляцию нервов также обусловлено изменением временных характеристик симпатической нервно-мышечной передачи под влиянием дезипрамина. Следует отметить, что этот факт может иметь важное значение для регуляции уровня артериального давления в организме. Было показано, что при введении дезипрамина бодрствующим крысам частота нейрогенных колебаний снижается с 0,4 до 0,1 Гц Bertram et al. [7]. Такие колебания артериального давления (волны Майера) отражают ритм эфферентной симпатической активности, формируемый барорецепторным рефлексом [6, 11]. Поскольку частота нейрогенных колебаний артериального давления зависит от временных характеристик сосудистого ответа [6], можно предположить, что дезипрамин, изменяя свойства симпатической нервно-мышечной передачи, влияет на механизмы барорефлекторной регуляции сосудистого тонуса.
Работа выполнена при поддержке РФФИ (гранты
Литература
Effect of desipramine on neurogenic contraction of isolated rat tail artery
O. S. Tarasova1, A. V. Zotov1, I. M. Rodionov1, V. O. Golubinskaja2, A. S. Borovik3
1Department of Human and Animal
Physiology, Faculty of Biology, M.V.Lomonosov Moscow State University;
2Lab of gravitation physiology, Space Biomedical Center for Training
and Research;
3Lab of Cybernetics, A.V.Vishnevsky Surgery Institute,
Moscow, Russia
Recently we developed a technique for investigation of the response of isolated and isobarically perfused vessels to electrical stimulation of intramural sympathetic nerves. This technique can be useful to study the effects of pharmacologic agents on neurogenic contraction. In experiments with rat tail artery we applied this technique to study the effects of noradrenaline reuptake blocker, desipramine. During stimulation of the nerves with 10-s bursts of impulses desipramine increased both contraction time and relaxation time but had no effect on the amplitude of the response and the rate of the contraction. In another set of experiments the nerves were stimulated by modulated sine pattern (the frequency of stimulation varied by ± 1Hz around the base value of 2 Hz), thereby imitating the rhythms observed in efferent sympathetic nerves. Sine stimulation with frequencies up to 0,2 Hz evoked frequency-matched oscillations of the flow, which were superimposed on the tonic contraction of the vessel, higher frequencies induced the tonic contraction only. The amplitude of flow oscillations prominently reduced in the presence of desipramine. In addition, desipramine increased time delay of neurogenic changes of vessel resistance, this effect may be important for dynamic control of arterial blood pressure.